Termováček
Abstrakt
Některé kapaliny lze za určitých podmínek udržet v nestabilní kapalné fázi i za teplot a tlaků nižších, než jsou jejich hodnoty v trojném bodě. Pak lze vyvolat rychlou krystalizaci, při níž dojde k uvolnění vnitřní energie a k zahřátí. Jednoduchá měření spojená s tímto jevem lze demonstrovat např. na termováčku (heat pack, firebag...).
Popis funkce
Termováček byl patentován v Kalifornii roce 1978 pod patentním číslem 4077390. Dnes jej lze v ČR zakoupit např. ve sportovních potřebách nebo lékárnách. Termováčky, se kterými jsme prováděli pokusy, jsou z Německa. Termováčky prodávané pod obchodním jménem FIREBAG mají na zadní straně je uvedeno, že pracovní látkou je octan sodný. Váček je z plastu, uvnitř je bezbarvá kapalina, ve které plave oválný plíšek.


Termováček se aktivuje tak, že přes plastový obal ohneme plíšek a uvolníme. Pokud je termováček funkční, nastane uvnitř prudká krystalizace. Z jednoho bodu na obvodu plíšku se rychle do okolí šíří krystalická fáze, která přibližně za 10 s vyplní celý objem váčku. Termováček se prudce zahřeje na překvapivě vysokou teplotu a je schopen dosti dlouho (v závislosti na teplotě okolí) dodávat teplo například prokřehlým rukám. Po vychladnutí na pokojovou teplotu je obsah váčku velmi tvrdý, uvnitř je vidět zřetelná krystalická struktura.
Termováček je možné ohřát v horké vodě, která způsobí postupné roztátí krystalů až do původního stavu – bezbarvá kapalina. Výrobce na termováčku uvádí, že takto lze vykonat přibližně 500 cyklů.
Motivační pokus
Studentům je možné např. při laboratorních pracích z fyziky rozdat termováčky a každý si může vyzkoušet nastartování krystalizace. Jev je natolik pěkný a překvapivý, že bude studenty dobře motivovat k dalšímu bádání.
Automaticky se nabízejí otázky:
1. Na jakou teplotu se termováček zahřeje?
2. Kolik tepla je schopen odevzdat než se ochladí na původní teplotu?
3. Proč se termováček najednou zahřál?
4. Proč najednou začala krystalizace?
Studenti by sami mohli navrhnout, co je třeba změřit a jakým způsobem pro zodpovězení úkolů.
Měření a výpočty
1. Teplotu lze změřit běžným kapalinovým či elektrickým teploměrem. Horký termováček není zcela tuhý. Lze jej ohnout a obalit jím teploměr. Studenti by mohli odhadovat, jaká je teplota termováčku. Při měření teplota opakovaně vychází okolo 52 °C.
2. Množství tepla, které je schopen váček odevzdat okolí, bude možné zjistit pomocí kalorimetru. Vložením horkého termováčku do chladnější vody v kalorimetru nejprve určíme měrnou tepelnou kapacitu krystalické fáze octanu sodného. Z tohoto údaje pak bude možné vypočítat teplo, které váček odevzdá, než se ochladí z teploty 52°C na teplotu okolí.
Zde jsou uvedena data z měření tří termováčků:
Jejich teplota na počátku v kapalném stavu byla vždy t = 24,5 °C a po proběhnutí krystalizace bývá teplota pravidelně t* = 52 °C.
Vnitřní nádoba kalorimetru má hmotnost m2 = 215 g a je z hliníku, který má v tabulkách měrnou tepelnou kapacitu c2 = 896 J.kg.K–1.
Do kalorimetru byla nalita voda o hmotnosti m1 a po ustálení změřena teplota t1. Tabulková hodnota měrné tepelné kapacity vody je c1 = 4 180 J.kg-1.K-1.
Hmotnost termováčku je m2'. To je hmotnost octanu sodného, igelitového obalu a plíšku uvnitř. Rozříznutím jednoho nefunkčního váčku jsme určili hmotnost igelitového obalu a plíšku přibližně na 11 g. Odečtením této hmotnosti se dá určit hmotnost m2 octanu sodného ve váčcích za předpokladu, že obal a plíšek je přibližně všude stejný.
Po nastartování krystalizace byl váček vložen do kalorimetru. Vodu v kalorimetru bylo třeba promíchávat a čekat až se teplota ustálí na hodnotě t3.
Budeme-li předpokládat tepelnou výměnu pouze mezi termováčkem, vodou a vnitřní nádobou kalorimetru můžeme vypočítat teplo Q1, které odevzdal termováček než nastala v kalorimetru termodynamická rovnováha.
Q1 = c1.m1.(t3 - t1) + c2.m2.(t3 - t1)
Určíme měrnou tepelnou kapacitu krystalické fáze octanu sodného uvnitř termováčku za pomoci vzorce Q1 = c.m.(t* – t3):
![]()
S využitím c vypočteme teplo Q2, které by termováček ještě odevzdal, než by se ochladil z teploty t3 na teplotu t, kterou měl termováček ještě před vyvoláním krystalizace.
Q2 = c.m.(t3 – t)
Hledané teplo určíme jako součet Q = Q1 + Q2.
| t1/°C |
m1/g |
m2/g |
t/°C |
t3/°C |
m/g |
t*/°C |
Q1/J |
c/J.kg-1K-1 |
Q2/J |
Q/kJ |
| 24 |
334,1 |
215 |
24,5 |
33 |
118 |
52 |
14303 |
6379 |
6399 |
20,7 |
| 25,5 |
386,4 |
215 |
24,5 |
34 |
120 |
52 |
15366 |
7114 |
8110 |
23,5 |
| 25,5 |
396,4 |
215 |
24,5 |
33,5 |
114 |
52 |
14797 |
7016 |
7198 |
22,0 |
| t1 |
počáteční teplota vody |
| m1 |
hmotnost vody |
| m2 |
hmotnost vnitřní nádoby kalorimetru |
| t |
počáteční teplota termováčku |
| t3 |
teplota v kalorimetru při termodynamické rovnováze |
| m |
hmotnost octanu sodného |
| t* |
teplota termováčku po krystalizaci |
| Q1 |
teplo přijaté vodou a kalorimetrem |
| c |
měrná tepelná kapacita krystal. fáze octanu sodného |
| Q2 |
teplo , které by váček ještě mohl odevzdat |
| Q |
celkové možné teplo odevzdané do okolí |
Průměrná hodnota měrné tepelné kapacity krystalické fáze vychází přibližně c = 6 800 J.kg–1.K–1, průměrná hodnota tepla, které je schopen termováček odevzdat do okolí je Q = 22 kJ.
Pokud zavedeme pojem výhřevnost termováčku jako podíl ![]() , bude nám pro látku ve váčku vycházet průměrná hodnota 188 kJ.kg–1.
, bude nám pro látku ve váčku vycházet průměrná hodnota 188 kJ.kg–1.
Odkud se vzala energie na zahřátí?
Vysvětlení dějů, které v termováčku probíhají není zřejmě jednoduché. V patentním zápisu se hovoří o tom, že jde o podchlazený roztok. Na internetu lze najít řadu cizojazyčných článků, které zkoumaný jev vysvětlují rozličně. Najdeme v nich pojmy přechlazená kapalina, přesycený roztok, podchlazená tavenina. Uvolněné teplo je nazýváno teplem fázové přeměny, exotermickou reakcí. Spuštění krystalizace je spojováno s uvolněním krystalizačních jader z mikrotrhlin v plíšku nebo prostě s ohnutím plíšku.
Podívejme se na to, co zná gymnaziální student. Ve fyzice se dozvěděl, že ochlazování kapaliny vede k tuhnutí. Jestliže kapalina vznikla táním krystalické látky, vznikají při teplotě tuhnutí nejprve krystalizační jádra, tzv. zárodky atd.
Někteří se dozvědí poznatek napsaný v poznámce učebnice [1]: Při tuhnutí čisté látky se často stává, že zárodky pevného skupenství se vytvoří až za teploty menší než je teplota tuhnutí dané látky. O kapalině, která má nižší teplotu, než je teplota tuhnutí dané látky, říkáme, že je přechlazena. Např. thiosíran sodný, který má teplotu tání asi 48 °C, může zůstat tekutý ještě asi při teplotě 20 °C. Vhodíme-li do takto přechlazené kapaliny několik krystalků thiosíranu sodného, přejde kapalina rychle v pevnou látku a teplota soustavy vzroste na teplotu tuhnutí.
Jak studentovi vysvětlit, odkud se teplo uvolnilo? Pokud nechceme používat slovník chemiků, mohli bychom vyjít z přeměn potenciální energie na kinetickou. Jednoduše lze říci, že krystalická fáze má pevnější vazby než fáze kapalná. Pevnější (těsnější) vazby znamenají snížení potenciální energie. Protože platí zákon zachování energie i ve světě atomů, molekul a iontů, musí následně vzrůst kinetická energie jejich kmitavého pohybu. To se projeví na vzrůstu teploty termováčku.
Problém vidím v chápání pojmu potenciální energie vzájemné polohy částic. Zjednodušeně by se asi studentům dalo říci o změnách potenciální energie tíhové (Ep = mgh), kterou mají nejvíce zažitou. Klesne-li vzdálenost h mezi tělesem a zemí, klesne také potenciální energie Ep. Pokud těleso padá na zem, klesá jeho potenciální energie a roste kinetická energie posuvného pohybu. To je trochu nepřesná, ale pro studenty 2. ročníku čtyřletého studia snad přijatelná analogie.
Termojaderná syntéza
Celé úvahy o termováčku zatím směřovaly do termodynamiky. Termováček je ale vhodný i při výkladu termojaderné syntézy, kde opět mluvíme o uvolnění energie. Principiálně jde vlastně o totéž. Na počátku je třeba dodat určitou energii, aby se atomová jádra dostala na dosah jaderných sil. Jakmile se začnou vytvářet nové pevnější vazby mezi nukleony, klesá potenciální energie vazebních sil a následně roste kinetická energie kmitavého pohybu. Ta se projeví jako prudké zahřátí hmoty.
Starší studenti by zároveň měli pochopit zásadní rozdíly. U termováčku jde o změny potenciální energie elektrických sil (energie se uvolňuje z elektronového obalu), zatímco u termojaderné syntézy jde o změny potenciální energie jaderných sil (energie se uvolňuje z jádra). Rozdíl je pochopitelně v množství uvolněné energie.
Elektrická potenciální energie
Ve fyzikálním semináři by se dal pojem elektrická potenciální energie zpřesnit. Pro jednoduchost odvodíme potenciální energii dvojice nesouhlasných nábojů Q1 a Q2, které se nacházejí ve vzdálenosti r.
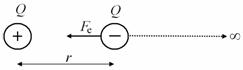
Je třeba začít definicí potenciální energie.
1. Jestliže vzdálenost nábojů je nekonečná, je jejich vzájemná potenciální energie nulová.
2. Jestliže vzdálenost nábojů je r, pak potenciální energie bude rovna práci, kterou vykoná elektrické pole při přesunu jednoho náboje do místa kde bude vzájemná potenciální energie nulová.
Vzhledem k tomu, že Coulombova elektrostatická síla Fe klesá s druhou mocninou vzdálenosti x
![]()
bude třeba práci počítat integrálem. Ve výpočtu je navíc třeba zohlednit fakt, že úhel a mezi směrem posouváním náboje a směrem síly je 180°.
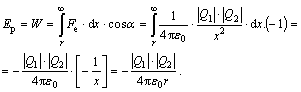
Z definice logicky vyšlo, že potenciální energie takovéto dvojice nesouhlasných nábojů je záporná. Odvozený vzorec můžeme využít v příkladu.
Příklad: Uvažujme dva nesouhlasné elementární bodové náboje ve vzdálenosti 0,3 nm. O kolik se změní jejich kinetická energie, jestliže se přiblíží na vzdálenost 0,2 nm?
|Q1| = |Q1| = e = 1,6.10-19 C, r1 = 0,3 nm, r2 = 0,2 nm
Řešení: Bude platit zákon zachování energie
![]()
![]()
![]()
ΔEk = 3,83.10-19 J = 2,4 eV
Fakt, že potenciální energie dvojice nesouhlasných nábojů je záporná se v učebnici [1] u modelů skupenství nesděluje, naopak se říká, že u pevného skupenství je potenciální energie vazebních sil větší než kinetická energie kmitavého pohybu. To je ve sporu s její zápornou hodnotou.
Také v učebnici [2] by se měla zavést vazební jaderná energie Ej a vazební energie vztažená na 1 nukleon εj záporná. I tam by se učiteli lépe pracovalo se zákonem zachování energie. To je ale nutné zavést hmotnostní schodek jádra také jako záporné číslo. Při výkladu to používám.
Následující příklad termojaderné syntézy budeme řešit analogicky.
Př: Vypočtěte kinetickou energii uvolněnou při termojaderné syntéze deuteria a tritia na helium 4He. Vazební energie na jeden nukleon mají hodnoty
![]() .
.
Řešení: Nejprve zapíšeme rovnicí termojadernou syntézu
![]()
Bude platit zákon zachování energie, tedy součet jaderné energie (potenciální) a kinetické se zachovává.
![]()
![]()
... neutron má vazební energii nulovou
![]()
Změna kinetické energie vychází kladná, tedy energie roste a hmota se zahřívá.
Mechanismus dějů v termováčku
Co se tedy odehrává v termováčku po ohnutí plíšku? Dále půjde částečně o úvahy, které vycházejí z četby článků a vlastních experimentů.
Podívejme se na vlastnosti trihydrátu octanu sodného CH3COONa.3H2O. Tato látka má v pevné fázi hustotu 1,45 g.cm-3. Krystalizuje v monoklinické krystalové soustavě. Vytváří bezbarvé krystaly, v nichž mezi ionty jsou vmezeřeny dipóly vody. Při zahřátí na 58 °C se z krystalové mřížky začnou vylučovat molekuly vody, v níž se octan rozpouští. Dochází k tání látky a disociaci na ionty CH3COO- a Na+.
Při chladnutí roztoku však nedochází při 58 °C ke krystalizaci. Roztok se ochladí na běžnou pokojovou teplotu a vyskytuje se jako přechlazený roztok.
V termováčku se tedy nachází přechlazený roztok, u kterého se ohnutím plíšku vyvolá krystalizace a dojde k výše vysvětlovanému uvolnění tepla.
Zbývá vysvětlit, jak ohnutí plíšku způsobí krystalizaci. Myšlenku, že by spuštění krystalizace bylo spojováno s uvolněním krystalizačních jader z mikrotrhlin v plíšku je zřejmě třeba odmítnout. Lze totiž provést pokus, kdy v teplé vodě rozpustíme krystaly jen částečně a necháme termováček zchladnout.

Přestože jsou ve váčku při pokojové teplotě přítomny shluky krystalů plovoucích v kapalině, krystalizace samovolně nenastává. Pokud v takovém váčku ohneme plíšek, krystalizace proběhne normálně. Krystalizaci se ale podařilo vyvolat (u některých váčků) také stisknutím shluku krystalů!
Testovali jsme hypotézu, že by při ohnutí plíšku došlo k vyslání rázové vlny, která spustí krystalizaci. Pokud se ale snažíme vyvolat rázovou vlnu nárazy a pády váčku, ke krystalizaci nedochází. U některých plíšků ani při jejich ohnutí nedojde k typickému „lupnutí“, které by vlnu vysílalo.
Při pečlivém sledování počátku krystalizace lze pozorovat, že ohneme plíšek, uvolníme jej a teprve potom na některé z vylisovaných prohlubní vznikne centrum krystalizace. Odtud se krystalizace šíří v kruhu do všech částí termováčku.
Vypadá to tak, že prohlubně plíšku jsou nejvhodnějším místem vzniku krystalizace, která je vyvolána pod tlakem prstu.

Myšlenku o potřebě vyvolání tlaku potvrzuje i experiment se shlukem plovoucích krystalů.
Ještě jeden jev je velmi zajímavý. Některé váčky ztrácejí schopnost krystalizace. Když však byly propíchnuty kovovým hrotem, krystalizace se spustila v místě, kde hrot vnikl do roztoku.
Octanový sloup
Na závěr si ukažme experiment s přechlazeným roztokem octanu sodného, který není v termováčku. Krystalický octan rozpustíme v kádince a necháme zchladnout na teplotu blízkou pokojové. Na talířek vložíme několik krystalů octanu sodného a začneme pomalu zalévat roztokem z kádinky. Roztok na talířku okamžitě krystalizuje a před očima roste sloup podobný svíčce. Celý útvar se samozřejmě zase zahřeje.

Závěr
Článek seznamuje s funkcí termováčku a pokouší se vysvětlit mechanismy probíhající v termováčku z pohledu fyziky. Popisuje využití termováčku jako motivačního kvalitativního pokusu v hodině fyziky a také měření s termováčkem v laboratorních pracích z termodynamiky. Nad rámec základního gymnaziálního učiva se pracuje s potenciální elektrickou energií dvojice nábojů. Jsou uvedeny příklady výpočtu uvolněné energie při krystalizaci a analogicky při jaderné syntéze.
Literatura
[1] K. Baruška, E. Svoboda, „Molekulová fyzika a termika“, (1993)
[2] I. Štoll, „Fyzika mikrosvěta“, (1993)
[3] Patent No. 4,077,390, Reusable heat pack containing supercooled solution and means for activating same, United States Patent and Trademark Office, http://patft.uspto.gov/
[4] Sodium Acetate, Wikipedia, http://en.wikipedia.org/wiki/Sodium_acetate
[5] Prof. Blumes Bildungsserver für Chemie, Tipp des Monats Januar 1999, Wärmekissen: Schnelle Wärme aus Kristallen, http://dc2.uni-bielefeld.de/dc2/index.html