O příspěvku
Zaujímavá elektrolýza
pozn. editora: Ve sborníku je zařazena pouze část příspěvku.
Jednoduché meranie náboja elektrónu
Pri meraní naboja qe elektrónu použijeme plastovú injekčnú striekačku (obr. 1a), ktorú naplníme slabým roztokom kyseliny sírovej. V domácich podmienkach ju možno získať z akumulátora automobilu napr. pomocou malej plastovej trubičky, alebo injekčnej striekačky. Ide len o 3-4 kvapky tejto kyseliny, ktoré slúžia na prípravu asi 3 cm3 roztoku.
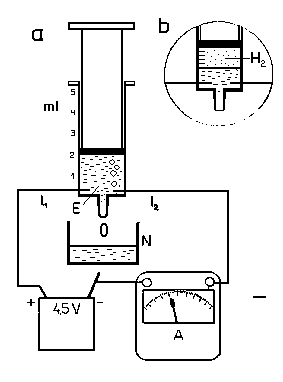
Obr. 1
Do striekačky natiahneme napr. 2 cm3 tohto roztoku tak, aby v striekačke neostal vzduch. Striekačku s roztokom fixujeme vo zvislej polohe, otvorom nadol. V blízkosti dna striekačky zabodneme do striekačky dve ihly, ktoré budú slúžiť ako elektródy. Potom striekačku zapojíme do elektrického obvodu a pod ústie striekačky podložíme sklenú nádobku. Do nej budú odkvapkávať kvapky roztoku. Ten je zo striekačky vytláčaný v dôsledku vylučovania plynu v priebehu elektrolýzy. Pri prechode prúdu roztokom sa totiž na jednej ihle-katóde vylučujú bublinky vodíka.
Napájacím zdrojom je bežná plochá bateria 4,5 V. Jeden mililiter (1 cm3) vodíka sa vylúči asi za 5 minút. Práve ten vytláča zo striekačky časť roztoku. Skupina SO4, ktorá sa vylučuje sa na ihle-anóde sa viaže so železom ihly na FeSO4. Táto látka má podobu tenkej vrstvy, takže navonok sa na anóde nič nedeje. Po vytlačení jedneho mililitra vodíka elektrolýzu prerušíme (Obr. 1b). Práve z dôvodov, aby sme vylúčenie takého množstva mohli lepšie určiť, je začiatočný objem elektrolytu celistvým násobkom mililitra.
Náboj qe elektrónu určíme z počtu N vylúčených molekúl vodíka a z veľkosti elektrického náboja Q = I.t, ktorý prešiel obvodom počas elektrolýzy. Meriame teda jednak prúd I, jednak čas elektrolýzy t. Každej vylúčenej molekule zodpovedá prechod dvoch elektrónov obvodom (jeden elektrón jednému vylúčenému iónu vodíka). Počet prejdených elektrónov je teda 2N. Tomuto počtu prešlých elektrónov zodpovedá celkový prenesený náboj Q = 2Nqe. Porovnaním oboch vyjadrení náboja dostávame 2Nqe = I.t, z čoho
![]() .
.
Počet vylúčených vodíkových molekúl určíme na základe poznatkov o plynoch. Ak sa uspokojíme s hrubším určením náboja elektrónu, môžeme za počet N vylúčených vodíkových molekúl vziať približne počet molekúl plynu v 1 cm3 za normálnych podmienok, čo je asi 2,7.1019 (Loschmitovo číslo). Dostaneme ho ak Avogadrovu konštantu vydelíme objemom molu v cm3 (za normálnych podmienok). (Presnejšie určenie hodnoty N vyžaduje aj zistenie teploty a zmeranie atmosferického tlaku.
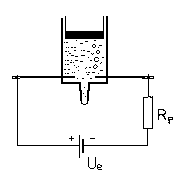
Obr. 2
Merať sa dá aj bez ampérmetra
Poznamenajme, že náboj elektrónu sa dá určiť približne aj bez ampérmetra. V tom prípade zapojíme do obvodu namiesto ampérmetra rezistor o známém odporu, napr. 1 kΩ, ktorý je značne väčší, ako odpor elektrotytu (Obr. 2). Prúd určíme približne z Ohmovho zákona, pravda s tým, že odpor elektrolytu v porovnaní so zaradeným odporom Rp zanedbáme. Doba elektrolýzy sa však predľži - bude závisieť aj od napätia použitého zdroja.