O příspěvku
PDF ke staženíCo je to luminiscence?
ÚVOD
Lidé jsou odpradávna fascinováni světelnými jevy. Mezi tyto jevy patří i tzv. luminiscence, o jejímž pozorování máme zmínky už z 10. století z Číny; nám je však důvěrně známá díky světluškám.
Luminiscence (dle [1], [2]) je spontánní (samovolné) záření obvykle pevných nebo kapalných látek, které vzniká jako přebytek záření tělesa nad úrovní jeho tepelného záření v dané spektrální oblasti při dané teplotě, přitom toto záření má určitou dobu doznívání, tedy trvá i po skončení budícího účinku. To znamená, že světelné záření vyzařované tělesem není spojeno pouze s jeho teplotou (Wienův posunovací zákon viz [3]), ale i s jiným dějem, tzv. luminiscencí.
Luminofor je látka, u které nastává luminiscence (tzv. světélkující látka).
Jak vzniká luminiscence? (viz [4])
Luminiscence vzniká vybuzením atomu luminoforu do excitovaného stavu[1] (tj. energeticky bohatšího) a následným návratem atomu do základního stavu, při kterém dojde k vyzáření fotonů.
| luminofor (základní stav) + energie luminofor* (excitovaný stav) |
→ → |
luminofor* (excitovaný stav) luminofor (základní stav) + světlo |
Druhy luminiscence
Luminiscenci dělíme
a) dle způsobu excitace:
Fotoluminiscence − vyvolána elektromagnetickým zářením (např. zářivka)
Elektroluminiscence − vyvolána elektrickým polem (např. luminiscenční dioda, reklamní panely, nouzové osvětlení)
Katodoluminiscence − vyvolána dopadajícími elektrony (např. stínítko televizní obrazovky, osciloskopu)
Chemoluminiscence (chemiluminiscence) − vyvolána chemickou reakcí
Bioluminiscence – způsobena chemickou reakcí vytvořenou živými organismy
Termoluminiscence − vyvolána vzrůstem teploty po předchozím dodání energie (např. termoluminiscenční dozimetry)
Radioluminiscence − vyvolána působením jaderného záření
Mechanoluminiscence – vyvolána mechanickou energií
Triboluminiscence − vyvolána třením
Fraktoluminiscence − vyvolána lámáním
Piezoluminiscence − vyvolána tlakem způsobujícím elastickou deformaci
Sonoluminiscence − vyvolána zvukovým vlněním (ultrazvukem)
b) dle doby trvání luminiscence po skončení excitace (tzv. dosvit):
Fluorescence − luminiscence zmizí s přerušením excitace
Fosforescence − luminiscence trvá i po přerušení excitace (několik minut až hodin)
MECHANOLUMINISCENCE (viz [5])
Cukr přeci nesvítí?
Pomůcky: cukr, kleště nebo palička
Postup: Zavřeme se do temné místnosti. Doporučujeme neprovádět pokus ihned, ale počkat několik minut, než se oči přizpůsobí temnotě a budou schopny vnímat slabé světélkování. Uchopíme kostku cukru do kleští nebo drtíme cukr paličkou či jiným masivním předmětem. Pozorujeme slabé modré světélkování. Cukr můžeme drtit i zuby před zrcadlem.
Vysvětlení: Když se rozlomí krystaly cukru, jedna část má přebytek elektronů, zatímco druhá má přebytek kladných iontů. Téměř okamžitě elektrony přeskočí trhlinu v porušeném krystalu, a tak se obě strany nábojově vyrovnají. Elektrony se sráží s dusíkem obsaženým ve vzduchu, dodají mu energii, excitují ho a on ji pak vyzařuje ve formě UV záření, doprovázeného trochou viditelného modrého světla. Mechanoluminiscence je kvantový jev, jeho mechanismus není ještě zcela vysvětlen.
CHEMILUMINISCENCE (viz [6])
V tomto případě je zdrojem excitace chemická (popřípadě biochemická) reakce. Není třeba tedy žádného excitačního záření, ale vlastní chemická reakce dodá energii, jejíž část je poté přeměněna na světlo.
Chemiluminiscence při krystalizaci
Chemikálie: síran sodný, síran draselný, destilovaná voda
Postup: 81,5 g síranu sodného a 200 g síranu draselného rozpustíme v co nejmenším množství asi 90 °C vody. Po rozpuštění všech krystalů necháme směsný roztok chladnout. Při chladnutí se z roztoku vylučují krystaly podvojného síranu draselno-sodného a objevují se jiskry (první jiskry lze pozorovat již při teplotě okolo 60 °C, asi po hodině od zahájení reakce lze pozorovat celé snopky jisker).
2 K2SO4 + Na2SO4 + 10 H2O → 2 K2SO4 · Na2SO4 · 10 H2O
Chemiluminiscence alkalické směsi pyrogallolu a formaldehydu
Chemikálie: pyrogallol (1,2,3-trihydroxybenzen), uhličitan draselný, 35 % roztok formaldehydu, 30% roztok peroxidu vodíku
Postup: Připravíme si roztoky.
Roztok A: 1 g pyrogallolu rozpustíme v 10 ml destilované vody
Roztok B: 10 ml 35–40% roztoku formaldehydu
Roztok C: 5 g uhličitanu draselného rozpustíme v 10 ml vody
Roztok D: 15 ml 30% roztoku peroxidu vodíku
Ve stomililitrové kádince smícháme roztoky A–C. Vzniklou směs přelijeme do prostorné (alespoň litrové!) Erlenmeyerovy baňky. Do této směsi přilijeme v zatemněné místnosti roztok D. Směs začne červenooranžově chemiluminiskovat.
Vysvětlení: Vznik světla je způsoben přeměnou chemické energie při redoxních reakcích, ve kterých peroxid vodíku oxiduje formaldehyd a pyrogallol. Při reakci vzniká celá řada produktů (kyselina mravenčí, oxid uhelnatý, oxid uhličitý) a současně je emitováno světlo oranžové barvy.
Upozornění: Je velice důležité provádět reakci skutečně v prostorné nádobě, neboť při reakci dochází k silnému pěnění směsi. Při přidávání roztoku D odvraťte hrdlo baňky od sebe i od všech přihlížejících osob, jelikož při reakci dochází k uvolňování tepla a k následnému varu reakční směsi, což vede k uvolňování formaldehydu, který štiplavě zapáchá a je toxický.
Případný možný nezdar pokusu může být způsoben zejména nízkou kvalitou pyrogallolu (bílý prášek či šupinky). Ochotně reaguje se vzdušným kyslíkem, který jej však znehodnocuje.
Chemiluminiscence luminolu
Chemikálie: luminol, 30 % roztok peroxidu vodíku, uhličitan sodný, hydrogenuhličitan sodný, uhličitan amonný, síran měďnatý, destilovaná voda
Postup: Připravíme si roztoky.
Roztok A: V 60 ml destilované vody rozpustíme 0,4 g uhličitanu sodného a 0,2 g luminolu. Po rozpuštění obou látek přidejme 2,4 g hydrogenuhličitanu sodného, 5 g uhličitanu amonného a 0,4 g síranu měďnatého. Po rozpuštění všech látek doplníme roztok na 100 ml.
Roztok B: 6 ml 30% peroxidu vodíku doplníme vodou na 100 ml.
Chemiluminiscenční reakci spustíme přilitím roztoku B do roztoku A.
Vysvětlení: Při oxidaci luminolu peroxidem vodíku v zásaditém prostředí a za katalýzy (ionty mědi) dochází k luminiscenci.
Tip: Barevnost vyzařovaného světla je standardně světle modrá, do jisté míry ji lze však ovlivnit přidáním malého množství fluorescenčního barviva (např. fluorescein pro žlutou, eosin pro oranžovou a rhodamin pro červenou chemiluminiscenci), tj. do roztoku A přidejme malé množství (asi na špičku nože) barviva.
Měsíční fontána (modifikace chemiluminiscence luminolu)
Chemikálie: luminol, uhličitan sodný, uhličitan amonný, 30% peroxid vodíku, síran měďnatý, koncentrovaný roztok amoniaku, hydroxid sodný
Postup: Sestavíme aparaturu dle Obr. 1. Dnem obrácenou baňku je nutno nejprve naplnit plynným amoniakem, to nejlépe provedeme tak, že do plastové lahve nasypeme pár peciček hydroxidu sodného a zalijeme roztokem amoniaku (hydroxid vytěsní z roztoku rozpuštěný plynný amoniak). Na ústí plastové lahve přiložíme baňku a počkáme. Po dostatečném naplnění baňky amoniakem (navlhčený lakmusový papírek přiložený k ústí baňky zmodrá, fenolftaleinový zčervená) baňku ihned uzavřeme zátkou s trubičkami ponořenými do obou roztoků a vstříkneme do baňky 10 ml destilované vody ze stříkačky.
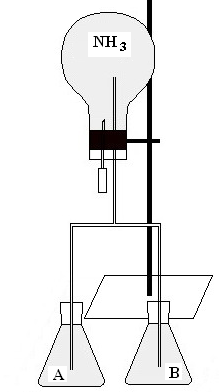
Obr. 1: Aparatura
Vysvětlení: Amoniak bude mít tendenci se ve velmi malém množství vody rozpustit (amoniak je po chlorovodíku nejlépe rozpustným plynem ve vodě – ve 100 ml vody se rozpustí 72 g amoniaku, což při jeho hustotě 0,0008 g.cm-3 odpovídá 90 dm3 amoniaku) a v baňce díky tomu dojde k poklesu tlaku. Proto se do baňky začnou nasávat roztoky A a B a po jejich smísení dojde k chemické reakci, při níž se uvolňuje chemiluminiscenční záření.
Červený trpaslík
Chemikálie: hydroxid sodný, peroxid vodíku 30%, koncentrovaná kys. chlorovodíková, oxidační činidlo (KMnO4, MnO2, … )
Postup: Vytvoříme si zásobní roztok hydroxidu sodného (12 g/100 ml roztoku) a spolu s 30% roztokem peroxidu vodíku jej vychladíme asi na 4 oC. Do baňky nasypeme přibližně 1 g hypermanganu (KMnO4) nebo burelu (MnO2) a uzavřeme ji nejlépe provrtanou gumovou zátkou s tzv. kvasnou rourkou a propíchnutou injekční jehlou. Roztoky hydroxidu sodného a peroxidu vodíku smícháme v poměru 4:1 a vlijeme do baničky kvasné rourky. Do stříkačky nasajeme asi 5 ml koncentrované kyseliny chlorovodíkové, nasadíme na jehlu a v průběhu pokusu kyselinu vstřikujeme do baňky. Uspořádání aparatury viz obr. 2 (přejato a upraveno z [7]).
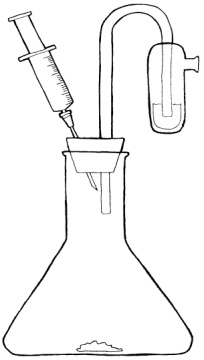
Obr. 2: Aparatura
Vysvětlení: Zelenožlutý plyn, který vzniká v reakční baňce, se nazývá chlor. Vyznačuje se štiplavým zápachem. Při pokusu jej vzniká poměrně málo, a pokud zátka dobře těsní, není cítit. Chlor dobře reaguje se zásaditým roztokem peroxidu vodíku. V roztoku nejprve vznikají chlornanové anionty. Jakmile se jimi roztok nasytí, začne vznikat na energii bohatá forma kyslíku s poměrně krátkou dobou existence, tzv. singletový kyslík. Každá bublinka chloru, která probublá baničkou kvasné rourky, pak vyvolá červeného trpaslíka, tj. červeně světélkující bublinky singletového kyslíku.
Další zajímavé pokusy lze nalézt v [4], [6] (tyto pokusy však narážejí na nedostupnost používaných chemikálií).
Ostatní
Na principu chemiluminiscence fungují světelné tyčinky (tzv. lightsticky), které vydávají studené světlo. Ty obsahují dva roztoky, z toho jeden v zatavené skleněné ampuli. Po rozlomení této ampule dojde ke smíchání obou roztoků a následné luminiscenci (princip oxidace peroxidem vodíku). Podrobněji viz [4].
Chemikálie
Většina chemikálií je v běžné středoškolské laboratoři dostupná. Pokud chceme provádět pokusy s luminolem[2], dá se sehnat u distributorů chemikálií (např. PENTA).
FOTOLUMINISCENCE
Celá řada zejména organických, ale i anorganických sloučenin je schopna se excitovat absorbovaným zářením a tuto excitační energii pak vyzářit opět jako elektromagnetické záření o stejné nebo větší vlnové délce.
Zdroje UV záření
Jako zdroj UV záření můžeme použít UV lampu používanou ke zjišťování pravosti bankovek (cena cca 500 Kč) nebo vlastnoručně vyrobenou UV lampičku (cena do 50 Kč).
Jak si vyrobit UV lampičku?[3]
Pomůcky: UV dioda[4] (390 nm), rezistor (50 –60 Ω, na 0,6 W), plochá baterie (4,5 V), vodiče, kancelářská sponka, kousek hadičky, páska
Postup: Dioda je stavěná na napětí 3,5 V, proto musíme ze zdroje „srazit“ 1 V na odporu. Je dobré vodiče připájet, ale stačí, pokud je přilepíme lepící páskou. Přes odpor natáhneme hadičku, kterou připevníme izolační páskou (aby se nedotýkaly póly + a − ). Stačí jen vyzkoušet polaritu, ve které lampička svítí, a lampička je hotová.
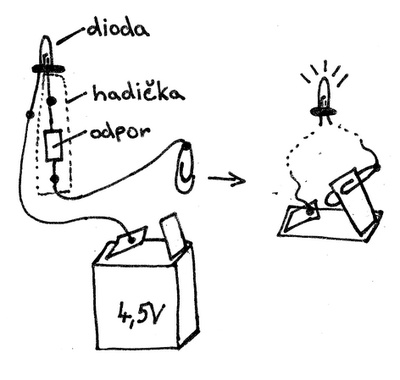
Obr. 3: Obrázek k postavení UV lampičky
FLUORESCENCE (viz [8])
Fluorescein, eosin, rhodamin
Chemikálie: indikátor fluorescein[5], eosin, rhodamin, hydroxid sodný, destilovaná voda
Postup: Rozmícháme trochu fluoresceinu (eosinu, rhodaminu) ve vodě. Ten již fluoreskuje při denním světle žlutozelenou (oranžovou, červenou) barvou. Posvítíme UV lampou, luminiscence je intenzivnější. Je lepší rozmíchat barviva ve 2% roztoku hydroxidu sodného, luminiscence je intenzivnější.
Aeskuetin[6]
Pomůcky: kůra či pupeny jírovce maďalu („kaštan“), destilovaná voda
Postup: Kousky kůry dáme do Petriho misky s vodou. Po ozáření UV lampou pozorujeme, jak se aeskuetin postupně louhuje a vyzařuje modré světlo.
Chlorofyl
Pomůcky: zelené listy, aceton
Postup: Samotný list pod UV lampou nefluoreskuje. Energie je spotřebovávána na jiné děje (fotosyntéza…). Jestliže ale ten samý list nastříháme a necháme vylouhovat v acetonu, po osvícení UV lampou červeně svítí.
Zvýrazňovače
Pomůcky: zvýrazňovače, voda, líh
Postup: Zvýrazňovačem pokreslíme na sklo a posvítíme na něj. Začne svítit. Svítí již i obaly od zvýrazňovačů, ale i různé jiné “křiklavé” předměty. Zvýrazňovače obsahují tzv. luminofory. Můžeme si vytáhnout náplň ze zvýrazňovače a vylouhovat ji do vody nebo lihu (některé zvýrazňovače jsou rozpustné ve vodě, jiné v lihu – je třeba vyzkoušet). Dostaneme tak roztok, který po osvícení UV lampou bude svítit.
Ostatní
Je možné si též posvítit UV lampou na různé jiné látky a vyzkoušet, zda svítí.
Látky: bankovky a občanský průkaz (obsahují ochranné prvky), prášek na praní (obsahuje tzv. optické zjasňovače), tonic (osahuje chinin), zářivka, pomůcky k UV záření, cedulky s nápisem „nouzový východ”, bílé látky…
FOSFORESCENCE
Světlonoš
Pomůcky: škrtátka z krabiček od zápalek (nebo červený fosfor)
Postup: Do zkumavky natrháme několik škrtátek (nebo dáme na špičku nože trochu červeného fosforu). Zahříváme nad kahanem. Pozorujeme bílé světlo.
Vysvětlení: Červený polymerní fosfor Pn žárem depolymeruje na páry bílého fosforu P4, které v chladnějších částech zkumavky reakcí s kyslíkem a vzdušnou vlhkostí bíle září. Fosforescenci tu způsobuje částice HPO, která je meziproduktem oxidace bílého fosforu na vzduchu a která je při reakci produkována v elektronově excitovaném stavu.
Upozornění: Bílý fosfor je silně jedovatý a samozápalný, ale bezpečně jej lze připravit v malém množství zahřátím červeného fosforu (škrtátka obsahují červený fosfor a pojivo). Použitá škrtátka spalte.
Fluorescein
Pomůcky: fluorescein, kyselina boritá
Postup: Malé množství (na špičku nože) fluoresceinu rozetřeme s kyselinou boritou a nasypeme do zkumavky. Nad kahanem postupně tavíme na žlutozelené sklo. Zkumavku necháme vychladnout. Po nasvícení UV lampou uvedená hmota pár sekund fosforeskuje.
Ostatní (viz [8])
Déle fosforeskují (hodiny i dny) po nasvícení laky, které se připravují z tzv. „Sidotových blejn“, což je sulfid zinečnatý (ZnS) dopovaný těžkými kovy (Cu, Cs, Rb); jejich příprava je ovšem dost komplikovaná a obtížně realizovatelná ve školní laboratoři.
VÝSKYT A POUŽITÍ LUMINISCENCE
Luminiscence se vyskytuje všude kolem nás.
Zářivky[7], které se běžně používají, jsou založeny na fotoluminiscenci.
Za horkých letních nocí lze v přírodě pozorovat zelené světélkování svatojánských mušek, modrou mořskou záři (původcem jsou mořští prvoci) nebo sinavý sliz houbových plodnic některých světélkujících hub nebo jejich světélkující podhoubí. V tomto případě jde o tzv. bioluminiscenci[8]. Nejznámějším příkladem bioluminiscence ve střední Evropě jsou asi světlušky. Bioluminiscencí jsou známé i jiné organismy např. medúzy, ryby (mořský ďas). Světélkování ztrouchnivělého dřeva způsobuje dřevokazná houba václavka obecná, jejíž vlákna produkují nazelenalé světlo. Kuriozní bioluminiscencí je Tchajwanské světélkující prase, které vzniklo přidáním genetického materiálu z medúzy do prasečího embrya (tento proces má napomoci ve výzkumu kmenových buněk).
Také některé minerály vykazují luminiscenci.
S luminiscencí se dále setkáváme, pokud vlastníme hodinky, které ve tmě samovolně svítí.
Luminiscence se využívá v obrazovkách televizorů, osciloskopů, na cedulkách s nápisem „nouzový východ”, v termoluminiscenčních dozimetrech.
Podstatnou roli hraje luminiscence při diagnostice závažných onemocnění (AIDS, BSE…). V monitoringu čistoty ovzduší, kriminalistice (stopy krve) a vojenské chemii. Využívá se v tzv. studeném světle (lightsticku).
Vysoké intenzity fluorescence fluoresceinu se využívá i pro mapování podzemních toků. Takto bylo např. dokázáno vysypáním většího množství fluoresceinu do přítoku Rýna, že se voda z tohoto přítoku podzemím částečně dostává do Bodamského jezera, ačkoliv na povrchu jsou tyto vodní plochy oddělené. Po určité době po vysypání fluoresceinu totiž začala slabě fluoreskovat i voda v jezeře. (fluorescein je biologicky prakticky neškodný).
Luminiscence má také zastoupení v chemické analýze a fyzikálním měření (fluorescenční mikroskopy, skenery, spektrofluorimetry), ale i biologii (fluorescenční značení tkání).
Podrobněji viz literatura.
LITERATURA
[1] http://cs.wikipedia.org/wiki/Luminiscence#Vyu.C5.BEit.C3.AD [cit 2008-08-22]
[2] http://www.meredit.cz/content/view/241/27/ [cit 2008-08-23]
[3] http://www.gymhol.cz/projekt/fyzika/13_act/13_act.htm [cit 2008-08-23]
[4] http://projekt-cl.ujep.cz/ [cit 2008-08-24]
[5] http://www.gymfry.cz/zmp0506/jediny/pokus.html [cit 2008-08-24]
[6] http://chemiluminiscence.xf.cz/index.php [cit 2008-08-2]
[7] Bárta M.: Jak (ne)vyhodit školu do povětří. DIDAKTIS, 2004
[8] http://www.chempok.wz.cz/ [cit 2008-08-2]
Poděkování
- Katedře didaktiky fyziky MFF UK za poskytnutí prostředků na chemikálií
- Mgr. Z. Polákovi za podněty a ukázku výroby UV lampičky
- doc. RNDr. J. Dianovi, CSc., za odborné rady chemického rázu
- RNDr. V. Žákovi za cenné připomínky a pomoc při přípravě
- V. Barešovi za cenné podněty a pomoc při přípravě
- O. Šimůnkovi za svolení použití jeho práce (viz [6])
[1] Excitovaný stav je stav s vyšší energií. Vzniká tak, že látka v základním stavu přijme přesně vymezené kvantum, dávku, energie. V přírodě všechny stavy s vyšší energií jsou nestabilní, a přecházejí tudíž samovolně zpět ve stavy základní, energeticky stabilní. Excitované stavy částic mají obvykle velmi krátkou životnost (zlomky sekund).
[2]Jeho cena je 1 g (5 pokusů) cca 200 Kč.
[3] Vyrobeno dle námětu Mgr. Z. Poláka.
[4] Seženeme v prodejnách s elektrotechnickými součástkami (cena cca 10 Kč/ks). Ideální jsou diody, které vydávají světlo o vlnové délce menší než 400 nm.
[5]Tzv. „uranin“ nazvaný podle toho, že uranylové soli fluoreskují velmi podobnou barvou.
[6] Derivát kumarinu (podrobněji viz [8])
[7] Zářivka je tvořena trubicí naplněnou plynem, v níž probíhá výboj produkující UV záření. Toto záření však nepozorujeme. Pozorujeme až viditelné luminiscenční světlo, které vzniká dopadem UV záření na vrstvu luminiscenční látky pokrývající vnitřní stěny trubice (viz [2]).
[8] Celý proces je výsledkem oxidace luciferinu za přítomnosti enzymu luciferázy. Při této reakci se vyzařuje až 96 % světla a jen 4 % tepla, je tedy z hlediska daných organismů velmi efektivní (pro porovnání, u výbojek je světla jen 10%). Rovnice reakce se dá zapsat takto: luciferin + kyslík → oxyluciferin + světlo.